Notice
[주주공지] Vax-DC/MM 1/2a상 관련하여 회사의 입장을 전달 드립니다.
관리자 2022년 09월 06일 23:13 조회 5916
[주주공지] Vax-DC/MM 1/2a상 관련하여 회사의 입장을 전달 드립니다.
주주분들께,
조기 종료한 Vax-DC/MM 1/2a 상 임상연구 결과 등과 관련하여 오늘 당사의 입장 및 소견을 표명하였음에도 불구하고, 해당 기종료된 다발골수종 치료제 Vax-DC/MM 1/2a 임상연구에 대하여 다소의 논란이 제기되어 주주분들에게 혼란을 드릴 우려가 있어 이를 바로잡고자 아래와 같이 알려드립니다.
1차 지표에 대한 내용
임상시험계획서 개요에 ‘재발성 또는 불응성 다발골수종 환자에서 수지상세포를 이용한 임상 1/2a 연구’에 대한 1) 일차 목적 (primary end point)는 대상 환자에게 수지상세포를 투여하였을 때 그에 대한 안전성을 평가, 2) 이차 목적 (secondary end point)는 대상 환자에게 수지상세포를 투여하였을 때 면역학적 유효성 및 임상적인 유효성을 평가하는 것입니다.

<식약처로부터 승인받은 임상시험계획서 중 일부>
본 임상시험의 2차 목적인 유효성 평가편을 보면 본 임상시험의 이차 목적은 다발골수종 환자에게 수지상세포를 투여하였을 때 면역학적 반응과 임상적인 반응을 평가하는 것으로 아래에 기술한 주 결과 변수 및 2차 결과 변수에 대하여 평가합니다. 주 결과 변수는 면역학적 반응율과 임상적인 반응율이고, 2차 결과 변수는 삶의 질 평가입니다.
8월 29일의 박셀바이오 주주통신문 중 ‘다발골수종 특이적 T세포의 항암 면역반응을 1차 유효성 평가지표로 분석했습니다’라는 내용이 있습니다. 당사에서는 명확하게 1차 평가지표라는 용어를 사용하지 않았으며, 2차 목적인 유효성 평가 변수의 하나로 2차 결과 변수가 삶의 질 평가라는 항목이 있기 때문에 해당 2차 목적인 유효성 평가 변수 중 주 결과 변수인 면역학적 반응율과 임상적인 반응율 중 하나인 면역학적 반응율을 2차 결과 변수인 삶의 질과 비교하여 1차 유효성 평가라는 용어를 사용하였습니다.
혈액암의 유효성 평가지표에 대한 오해
저희 주주통신문에는 “일반적으로 고형암 치료제의 효능을 평가하는 수치는 객관적 반응률(ORR), 무진행생존기간(PFS), 완전 관해(CR), 전체 생존 평균(OS) 등이 있습니다. 하지만 혈액암의 효능을 평가하는 기준은 조금 다릅니다. Vax-DC/MM의 경우 혈액암 중 다발골수종을 대상 적응증으로 하여 임상연구를 진행했습니다. 다발골수종은 현재까지 완치가 없는 암종이며, 한 번 치료를 시작한 이후 계속해서 치료를 진행해야 합니다. 특히 혈액학적 수치로 효능을 판단하기 때문에, 치료 후 결과에서 SD(Stable Disease, 안정성 병변) 이상의 반응을 보이면 치료에 효과가 있다고 판단합니다” 라고 적혀 있습니다.
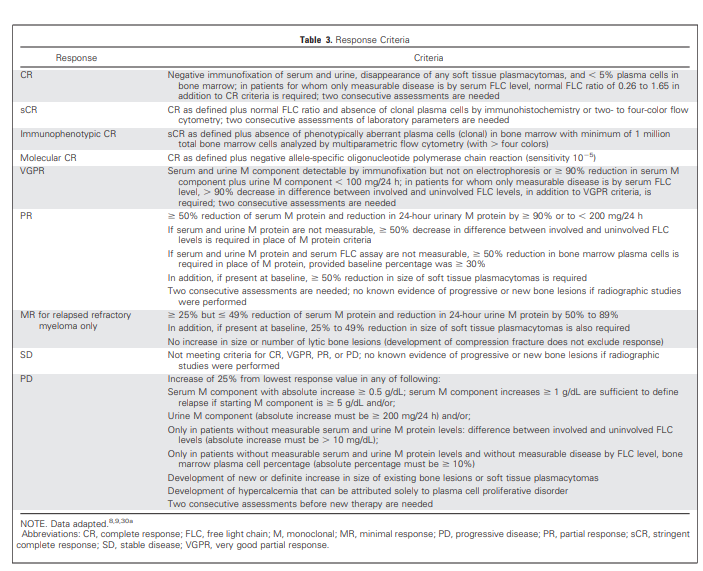
다발골수종은 다른 암종과 달리 반응률이 더욱 세분화되어 있는데, PR (Partial Response, 부분반응)에 도달하지 못해도 그 이하의 반응을 보이는 경우 MR (Minimal response, 최소반응, 25-49%)이라는 반응 기준이 있습니다. 따라서 ‘혈액암 (다발골수종)은 고형암과 다른 지표로 유효성을 평가한다”는 당사의 주장은 아래 첨부한 논문의 표와 같습니다.
또한, 임상연구 계획서에 보면 “안정성 질환(SD) 이상을 보인 경우 수지상세포 치료에 대한 반응군으로 정의한다”라고 기술되어 있습니다.
과거에는 임상 1상 연구에서 ORR 0%이어도 전세계적으로 다발골수종에서 성공적으로 개발된 약제인 Elotuzumab이 있습니다. 이 치료제는 선행치료를 많이 받았던 35명의 환자를 대상으로 Elotuzumab 단독치료를 수행하였는데 기사에서 언급한 ORR은 0%이지만, 9명(26.5%)의 환자가 안정성 질환(SD)을 보였습니다(Blood 2012:120:552-9). 그러나 여기에서 개발이 중단되지 않고 실험적 연구를 수행하여 lenalidomide와 병합요법을 하여 치료 상승효과를 확인하였고, 이를 토대로 Elotuzumab과 lenalidomide/dexamethasone 병합하는 2상 임상연구를 디자인하여 그 치료 효과를 입증할 수 있었으며(Lancet Haematol. 2015 Dec;2(12):e516-27), 최종적으로 3상 임상연구(Blood Cancer J. 2020 Sep 4;10(9):91)를 통해서 다발골수종의 중요한 치료제 중의 하나로 자리잡았습니다.
이와 비교해보면 당사에서 시행한 Vax-DC/MM 1/2a상 임상연구 결과를 보면 MR 11.1%, SD 55.6%를 보여서 Elotuzumab보다 더 높은 치료 결과를 보였으며, 또한 실험실적 예비연구에서 면역세포치료제인 Vax-DC/MM과 면역조절제인 lenalidomide를 병합치료 하였을 때 유의한 치료 상승효과를 보여서(Oncotarget 2017:8: 27252-27262), 식약처로부터 2상 임상연구 승인을 받았습니다.

<참고 논문>
면역학적 반응에 대한 내용
금번 조기 종료 공시에서 기재한 ‘77.8%라는 높은 면역학적 반응률을 보이는 등’은 기존에 논문 초록 및 본문은 물론, 상장 시 금융감독원에 제출한 증권신고서부터 최근 제출한 2022년 반기 사업보고서까지 수차례 사업에 대한 내용 중 일부로서 동일하게 기재되어 왔던 ‘면역학적 반응율(77.8%)과 임상적인 이득율(66.7%)’을 포함하는 것으로 금번에 새롭게 공시되거나 기재된 사항이 아닙니다.

수 년전 Vax-DC/MM 임상1/2a상 연구에서는 면역학적 반응율과 임상적이 이득율과의 상관관계가 발견되지는 아니하였으나, 논문에 기재되어 있는 바와 같이 해당 임상에 “등록된 환자군이 이전에 중앙값 5회 이상의 많은 치료를 받았던 재발 또는 불응성 다발골수종이고, 이러한 환자들은 많은 종양 부담(tumor burden)과 다양한 면역기전 회피 등이 있어서 면역치료제의 항 다발골수종 치료의 제한점”을 가져왔습니다.
그러면서 결론으로 “이전에 치료를 많이 받았던 다발골수종 환자에서 질환을 안정화시키는 활동도가 있다는 점과 향후 면역조절제와 면역관문억제제와 병합치료를 통해서 Vax-DC/MM의 치료 효과를 올릴 수 있는 연구가 필요하다” 라고 하였습니다.
최근 발생된 논란으로 인하여 박셀바이오에 대한 주주분들의 신뢰에 큰 영향이 발생되었습니다. 주주통신문을 통하여 잘못된 내용은 바로잡아, 한국 바이오 회사의 대표기업으로서 혁신 암면역치료에 대한 연구 개발 및 임상연구를 위해 최선을 다할 것이며, 주주분들의 믿음과 신뢰에 부응하도록 심혈을 다 할 것입니다. 금번의 당사 입장을 상세히 전달 드리면서, 향후 해당 Vax-DC/MM에 관하여 부정확하거나 정확한 사실을 전달드리고 묵묵히 연구에 전념하여 주주 및 회사가치의 제고를 연구결과로서 보여드리고자 합니다.
‘암 정복’에 대한 사명감으로 항암면역 치료분야를 20여년동안 전문적으로 연구하고, 또한 박셀바이오를 창립하여 현재까지 지켜온 대표로서 주주분들께 약속드립니다. ‘선택과 집중’을 통해 정비한 파이프라인으로 박셀바이오는 더욱 성장할 것이며, 이를 믿고 투자해주신 주주분들께 성과와 결과로 보답할 것이며 최고의 기술력을 가진 항암면역치료 회사로 성장하겠습니다.
감사합니다.
박셀바이오 대표이사 이제중 드림
